上新!FDA发布10篇吸入剂产品BE指南
发布时间:
2023-08-23 15:42
2023年8月21日,美国FDA官网发布了新一批 38 篇具体产品指南(PSG),包含10篇吸入剂产品指南,为仿制药开发和支持简化新药申请(ANDA)批准提供建议,从而帮助简化仿制药开发和 ANDA 审评,促进仿制药竞争。
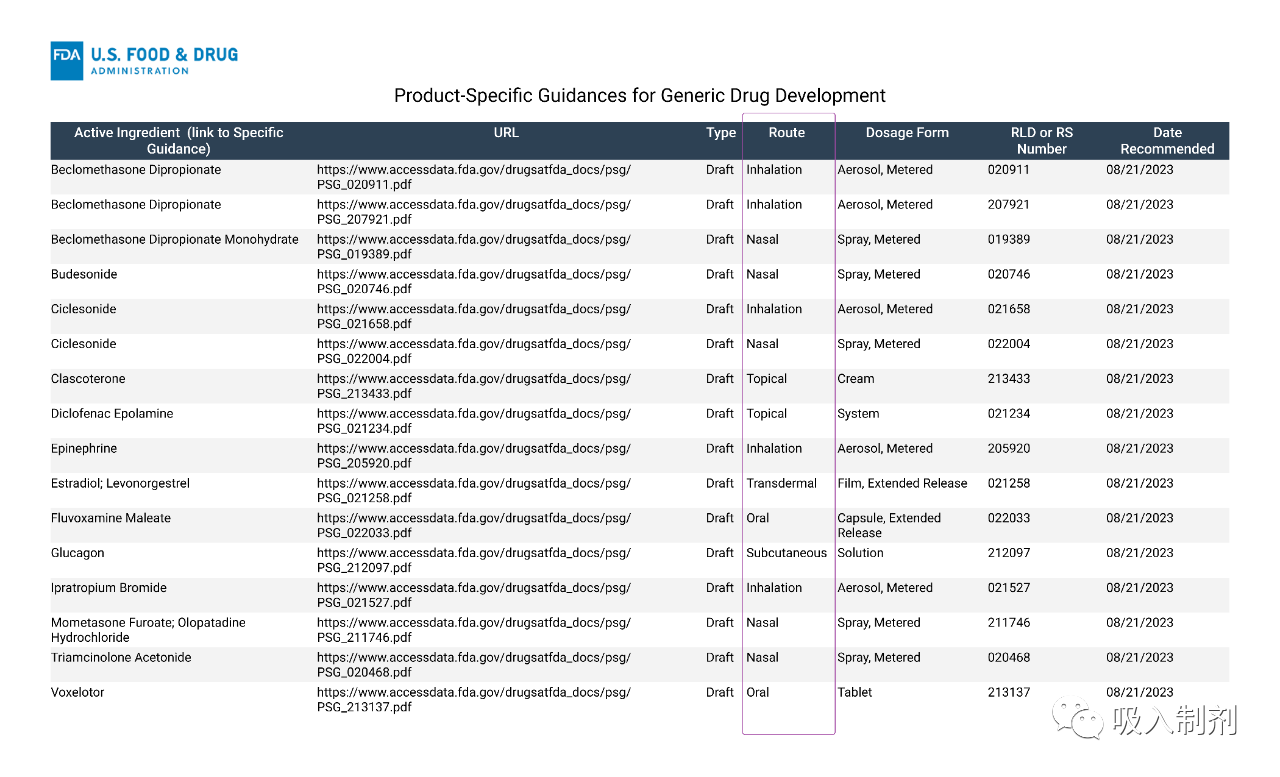
五种鼻用混悬液:二丙酸倍氯米松一水合物(RLD:BECONASE AQ,NDA 019389);布地奈德(RLD:RHINOCORT ALLERGY,NDA 020746);环索奈德(RLD:OMNARIS,NDA 022004);糠酸莫米松/盐酸奥洛他定(RLD:RYALTRIS,NDA 2117) 46 );和曲安奈德(RLD:NASACORT ALLERGY 24 HOUR,NDA 020468)。
FDA 修订了这五种鼻用悬浮液产品的 PSG,以推荐两种用于建立 BE 的方案并更新与器械相关的建议。通过这些修订,如果在待测产品和 RLD 之间配方相同、器械相似,则潜在申请人可以选择体外 BE 研究方案。作为体外 BE 研究方案的一部分,除了传统推荐的体外 BE 研究之外,还包括两项新研究:药物颗粒分布和溶解度研究。
方案 1:8项体外生物等效性研究
要符合本推荐方案的生物等效性证明条件,T 和 R 产品的制剂应在定性(Q1)1 和定量(Q2)2 相同,且鼻腔喷雾器 T 型产品的鼻腔喷雾装置(如泵和促动器设计)适用于ANDA。
Q1(定性相同性)是指 T 类产品使用的非活性成分与 R 类产品相同。
Q2(定量相同性)是指 T 类产品中使用的非活性成分的浓度与 R 类产品中使用的非活性成分的浓度在±5%以内。
FDA 建议未来的申请者对 T 类产品的三个或更多批次和 R 类产品的三个或更多批次中的每个批次的样品进行以下体外生物等效性研究,每个批次不少于 10 个单位。
FDA 建议,三个主要稳定性批次也用于证明体外生物等效性。T 产品的三个批次应至少由三个不同批次的药物物质、三个不同批次的关键辅料和三个不同批次的拟用于商业产品最终设备配置的设备组件(如泵和致动器)制造而成。
最终产品应包括拟上市的最终器械成分部分和最终药物成分配方。建议进行以下体外生物等效性试验:
1. 单揿含量(SAC)
2. 过激光衍射测量液滴大小分布
3. 小颗粒/液滴中的药物
4. 喷雾模式
5. 喷雾羽流几何形状
6. 充填与再充填
7. 药物粒度分布
8. 溶解
补充意见:关于上述体外生物等效性研究的设计和等效性标准的建议,以及关于开展体外生物等效性研究和提交数据的一般性建议,请参阅 FDA 关于丙酸氟替卡松鼻腔定量喷雾剂(NDA 020121)的最新版具体产品指南。
来源:吸入制剂微信公众号
内容附件
*.PDF文件点击文件名可在线访问
山东京卫制药有限公司
地址:山东省泰安市高新技术产业开发区配天门大街西首
邮编:271000
电话:0538-8926688 / 0538-8512277
传真:0538-8926066 / 0538-8511531
E-Mail: jwzy@jewim.com.cn
网址:www.jewimpharm.com

